 |
TLATEMOANI
Revista Académica de Investigación
Editada por Eumed.net
Año 16, no. 50 – diciembre 2025.
España-ISSN: 1989-9300
SEROPREVALENCIA DE TRYPANOSOMA CRUZI EN DONADORES DE SANGRE DE LA HUASTECA POTOSINA, MÉXICO (2019-2020)
Seroprevalence of Trypanosoma cruzi in blood donors from Huasteca Potosina, México (2019-2020)
Nancy Ruth Gallegos Flores
e-mail: maferdg2017@gmail.com
Hospital General de Ciudad Valles, Sistema IMSS-Bienestar
Ciudad Valles, San Luis Potosí, México
Juan Fernando Cárdenas González
e-mail : juan.cardenas@uaslp.mx
Zona Media, El Balandrán, UASLP-México
María Eugenia Sánchez Briones*
ORCID: https://orcid.org/0000-0001-9968-0322
e-mail : eugenia.sanchez@uaslp.mx
Lic. En Medicina
FEPZH-UASLP-México
*autor de correspondencia
RESUMEN
La enfermedad de Chagas, causada por Trypanosoma cruzi, representa un problema de salud pública en México, especialmente en la Huasteca Potosina. La transmisión transfusional es la segunda vía más frecuente de contagio, lo que hace indispensable el tamizaje obligatorio en bancos de sangre (NOM-253-SSA1-2012). Objetivo: Determinar la prevalencia de T. cruzi en donadores del Banco de Sangre del Hospital General de Ciudad Valles, San Luis Potosí (2019-2020), e identificar edad, sexo y distribución geográfica de casos positivos. Metodología: Estudio retrospectivo observacional descriptivo de 7,400 muestras de donadores (4,004 en 2019 y 3,396 en 2020). Las muestras fueron procesadas mediante Vitros EciQ para detectar anticuerpos anti-T. cruzi. Se aplicó estadística descriptiva calculando prevalencia por año, edad, sexo y municipio. Resultados: La prevalencia global fue 0.69% (2019) y 0.61% (2020). El grupo de 30-41 años presentó mayor prevalencia en ambos años. En 2019, el sexo masculino mostró mayor prevalencia (0.75%) versus femenino (0.35%). Los municipios con mayor prevalencia fueron San Antonio (6.38% en 2019; 5.71% en 2020), Coxcatlán (2.22% en 2019; 7.41% en 2020) y Tampacán (2.33% en 2019; 3.70% en 2020). Conclusiones: Los resultados confirman circulación activa de T. cruzi en la región huasteca potosina en adultos asintomáticos, con prevalencias inferiores a otros estudios nacionales. El tamizaje serológico obligatorio en bancos de sangre continúa siendo estrategia efectiva para prevenir transmisión transfusional de Chagas.
Palabras clave: Trypanosoma cruzi, Enfermedad de Chagas, Banco de Sangre, Prevalencia, Huasteca Potosina, Transmisión Transfusional, Seroprevalencia, Donadores de Sangre.
ABSTRACT
Introduction: Chagas disease, caused by Trypanosoma cruzi, represents a public health problem in Mexico, especially in the Huasteca Potosina region. Transfusional transmission is the second most frequent route of transmission, making mandatory screening in blood banks essential (NOM-253-SSA1-2012). Objective: To determine the prevalence of T. cruzi in blood donors at the Blood Bank of General Hospital of Ciudad Valles, San Luis Potosí (2019-2020), and identify age, sex, and geographical distribution of positive cases. Methodology: Retrospective observational descriptive study of 7,400 donor samples (4,004 in 2019 and 3,396 in 2020). Samples were processed using Vitros EciQ to detect anti-T. cruzi antibodies. Descriptive statistics were applied, calculating prevalence by year, age, sex, and municipality. Results: Overall prevalence was 0.69% (2019) and 0.61% (2020). The 30-41 years age group showed the highest prevalence in both years. In 2019, males showed higher prevalence (0.75%) versus females (0.35%). Municipalities with highest prevalence were San Antonio (6.38% in 2019; 5.71% in 2020), Coxcatlán (2.22% in 2019; 7.41% in 2020), and Tampacán (2.33% in 2019; 3.70% in 2020). Conclusions: Results confirm active circulation of T. cruzi in the Huasteca Potosina region in asymptomatic adults, with lower prevalences than other national studies. Mandatory serological screening in blood banks continues to be an effective strategy to prevent transfusional transmission of Chagas disease.
Keywords: Trypanosoma cruzi, Chagas Disease, Blood Bank, Prevalence, Huasteca Potosina, Transfusional Transmission, Seroprevalence, Blood Donors.
INTRODUCCIÓN
La enfermedad de Chagas, causada por el parásito protozoario Trypanosoma cruzi (T. cruzi), representa un problema emergente en países de primer mundo y sostenido desde su descripción en América Latina. Desde su descubrimiento en 1909 por el médico brasileño Carlos Chagas (Chagas, 1910), esta enfermedad ha sido reconocida por su capacidad para causar discapacidad, muerte, y rápida diseminación asociada a los mecanismos de transmisión, entre ellos, la vectorial y transfusional (Carrada-Bravo, 2004). La enfermedad de Chagas ha sido catalogada como prioritaria por la Organización Mundial de la Salud (OMS) entre las Enfermedades Tropicales Desatendidas (ETD, en inglés Neglected Tropical Disease´s NTD) ya que afecta principalmente a poblaciones vulnerables y marginadas (Organización Mundial de la Salud 2010). Su control contribuye directamente a los alcances de los Objetivos de Desarrollo Sostenible (ODS) número 3 “salud y bienestar”, número 1 “fin de la pobreza”, número 10 “reducción de desigualdades”, y número 11 “ciudades y comunidades sostenibles”. Para información actualizada a 2025, revisar el siguiente link: https://www.who.int/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis).
Los mecanismos de transmisión en seres humanos del parásito T. cruzi, su ciclo de vida y la historia natural de la enfermedad de Chagas son complejos. Desde el punto de vista clínico, la historia natural de la enfermedad de Chagas se caracteriza por un curso clínico bifásico que comprende una fase aguda inicial seguida de una fase crónica prolongada. A continuación, describiremos los aspectos clínicos, inmunológicos y serológicos que se han establecido para cada una de las fases. Para más información consultar a Molina et. al (2016) y Dias et. al. (2016).
La fase aguda se presenta inmediatamente después de la infección y tiene una duración aproximada de 4 a 8 semanas, se caracteriza por una elevada carga parasitaria circulante y detectable mediante métodos directos como microhematocrito, gota gruesa o reacción en cadena de la polimerasa (PCR). Durante este período, el parásito se disemina por el organismo, invadiendo principalmente al miocardio, el sistema nervioso y el sistema reticuloendotelial (Freilij et al 1995, Dias et. al., 2016; Molina et. al., 2016). Sin embargo, 70-80% de los individuos infectados cursan esta fase de manera asintomática o con síntomas confusos, lo que representa un desafío significativo para el diagnóstico temprano y la implementación de tratamiento oportuno (Dias et. al., 2016; Molina et. al., 2016). Cuando la fase aguda se manifiesta clínicamente, dichas manifestaciones varían dependiendo de la vía de entrada del parásito, la carga parasitaria inoculada y la respuesta inmunológica del huésped. Por ejemplo, el signo de Romaña (edema unilateral de color violáceo acompañado de conjuntivitis y adenopatía preauricular), es patognomónico de la enfermedad cuando la inoculación fue en la conjuntiva (Romaña C., 1935). Las manifestaciones sistémicas difusas incluyen fiebre prolongada, hepatoesplenomegalia, linfadenopatías generalizadas, y en casos más graves, miocarditis aguda que puede progresar a insuficiencia cardíaca o arritmias potencialmente fatales (5-10% de los casos). La meningoencefalitis chagásica aguda, aunque infrecuente, ocurre principalmente en lactantes y niños pequeños y conlleva una mortalidad alta (Carrada-Bravo, 2004; Cancino, 2016). Por otro lado, la respuesta inmune inicial involucra la activación de macrófagos, células dendríticas y la producción de citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α), la interleucina-12 (IL-12) y el interferón gamma (IFN-γ). Estas citocinas son cruciales para el control de la replicación parasitaria, pero también contribuyen al daño tisular característico de la enfermedad. Aunado a lo anterior, la respuesta adaptativa se caracteriza por la producción de anticuerpos IgM e IgG específicos contra múltiples antígenos parasitarios, así como por la activación de linfocitos T CD8+ citotóxicos y linfocitos T CD4+ cooperadores tipo Th1. Sin embargo, múltiples mecanismos de evasión inmune han sido desarrollados por el t. cruzi que le permiten establecer una infección crónica persistente, entre ellos se han descrito la expresión variable de glicoproteínas de superficie, la inhibición de la vía del complemento, y la capacidad de sobrevivir dentro de vacuolas intracelulares modificadas que evitan la fusión con lisosomas como los más relevantes y conocidos hasta ahora (Field-Cortázares y Escobedo-Ortegón, 2019; Cucunubá et. al., 2017).
Tras la resolución de la fase aguda, todos los infectados progresan a la fase crónica, que se subdivide en dos formas clínicas con implicaciones pronósticas e infecciosas diferentes: la forma indeterminada y la forma determinada o sintomática. La fase crónica indeterminada, también conocida como fase de latencia, representa el estado clínico de aproximadamente 60-70% de los individuos infectados y puede persistir durante décadas o incluso toda la vida sin progresar a manifestaciones clínicas específicas. Esta fase se caracteriza por serología reactiva para anticuerpos IgG anti-T. cruzi y ausencia completa de síntomas. La parasitemia en esta fase es muy baja e intermitente, lo que dificulta la detección directa del parásito incluso con técnicas moleculares sensibles. A nivel histopatológico, existe inflamación focal de bajo grado y persistencia de amastigotes tisulares en número reducido, principalmente en fibras miocárdicas y ganglios autonómicos del tracto gastrointestinal, aunque estos hallazgos solo pueden documentarse mediante estudios post-mortem o biopsias especializadas (Dias et. al., 2016; Cucunubá et. al., 2017).
La fase crónica determinada o sintomática se desarrolla en aproximadamente 30-40% de los individuos infectados, generalmente entre 10 a 30 años después de la infección inicial. La cardiopatía chagásica crónica constituye la manifestación más frecuente y grave, afectando a 20-30% de todos los individuos infectados. El espectro de alteraciones cardíacas es amplio e incluye trastornos de la conducción, arritmias ventriculares complejas, cardiomegalia con dilatación de cavidades, adelgazamiento de la pared ventricular con formación de aneurismas apicales característicos, y disfunción sistólica progresiva que culmina en insuficiencia cardíaca congestiva refractaria. La muerte súbita por arritmias malignas representa una causa importante de mortalidad en esta población. Las manifestaciones digestivas, presentes en aproximadamente 10% de los casos, resultan de la destrucción progresiva de los plexos nerviosos entéricos (plexos de Auerbach y Meissner), lo que conduce a alteraciones en la motilidad y dilatación segmentaria. El megaesófago chagásico se manifiesta con disfagia progresiva, odinofagia, regurgitación, pérdida de peso y riesgo elevado de neumonía aspirativa y cáncer esofágico. El megacolon produce estreñimiento progresivo severo, distensión abdominal, formación de fecalomas y, en casos extremos, vólvulo sigmoides que requiere intervención quirúrgica urgente. Entre 5-10% de los pacientes presentan afectación mixta con compromiso simultáneo cardíaco y digestivo. Las manifestaciones neurológicas periféricas, incluyen neuropatía autonómica con alteraciones de la termorregulación, hipotensión ortostática y disfunción vesical (Coura y Viñas, 2010; Molina et. al., 2016; Dias et. al., 2016).
Una vez en el torrente sanguíneo, y para cualquier mecanismo de transmisión (vectorial, transfusional o vertical) el ciclo de vida se resume en lo siguiente: los tripomastigotes inoculados invaden células nucleadas, principalmente fibras musculares cardíacas y lisas, así como neuronas del sistema nervioso autónomo, donde se transforman en amastigotes y se multiplican por división binaria. Posteriormente, los amastigotes se diferencian nuevamente en tripomastigotes, rompen la célula hospedera y reingresan al torrente circulatorio, perpetuando el ciclo de infección (Carrada-Bravo, 2004; Field-Cortázares y Escobedo-Ortegón, 2019).
Para la transmisión vectorial, que es la más común, se sabe que el T. cruzi requiere la participación de vectores hemípteros de la familia Reduviidae, subfamilia Triatominae, conocidos popularmente como chinches besuconas o vinchucas (rojo-Medina et al 2018, Salazar-Schettino et al 2016, Martínez-Ibarra et al 2015). En México, se han identificado 32 especies de triatominos, de las cuales al menos 15 tienen capacidad vectorial confirmada (Salazar-Schettino et al 2016). Para la huasteca potosina, las especies más importantes incluyen Triatoma dimidiata, Triatoma mexicana, Triatoma gerstaeckeri y Rhodnius prolixus. Estos vectores habitan preferentemente en viviendas de construcción rústica, con paredes de adobe sin recubrimiento, techos de palma o teja, y con presencia de grietas que facilitan el establecimiento de colonias (Salazar-Schettino et. al., 2016). La transmisión vectorial ocurre cuando el triatomino, después de alimentarse de sangre humana, defeca sobre la piel del huésped, depositando tripomastigotes metacíclicos presentes en sus heces. El rascado de la zona de la picadura facilita la penetración del parásito a través de la piel o mucosas.
La transmisión transfusional de T. cruzi constituye el segundo mecanismo de transmisión más importante de la enfermedad de Chagas, especialmente en áreas urbanas donde la transmisión vectorial ha sido controlada (Berrizbeitia et al 2014, Rocha-Muñoz et al 2014, Rojo-Medina et. al., 2018). La globalización y la migración humana asociada a esta han extendido el riesgo más allá de las fronteras latinoamericanas, reportándose seroprevalencias de 0.62% en Cataluña, España, con cifras que alcanzan el 10.2% en donantes bolivianos (Pirón et al 2008), y aproximadamente 1.0-3.9% en inmigrantes latinoamericanos en Canadá, Estados Unidos y Europa (Gascón et al 2010, Requena-Méndez 2015). En América Latina, las seroprevalencias reportadas presentan una marcada variabilidad, oscilando desde 0.08% en Boyacá, Colombia (Castañeda-Porras et al 2021), 0.17% en la región central de Colombia (Rocha-Muñoz et al 2014), 0.23% en México (Ramos-Ligonio et. al. 2022), 0.32% en Venezuela (Berrizbeitia et al 2014), hasta 0.4% en los registros nacionales de Colombia (Rocha-Muñoz et al 2014) y 1.4-1.8% en estados específicos de México como Puebla (Monteón et. al. 2005).
Para asegurar la seguridad transfusional en México, la Norma Oficial Mexicana NOM-253-SSA1-2012 "Para la disposición de sangre humana y sus componentes con fines terapéuticos" incluye un protocolo de tamizaje obligatorio para la detección de anticuerpos contra T. cruzi, entre otros protozoarios. Esta normativa establece que se debe realizar mediante pruebas de detección de anticuerpos con una sensibilidad y especificidad ≥95%, incluyendo ensayos inmunoenzimáticos, aglutinación directa, tiras reactivas u otras con especificación igual o mayor. Sin embargo, y aún con la aplicación de la NOM-253-SSA1-2012, existe entre 10-25% de riesgo de adquirir la enfermedad de Chagas por una transfusión sanguínea de un donante infectado asintomático en México. Este porcentaje puede aumentar en pacientes politransfundidos y varía según factores como la concentración de parásitos inoculados, el estado inmunológico del receptor y el componente sanguíneo transfundido (Cancino, 2016). El riesgo de transmisión por unidad transfundida de un donante infectado varía según la carga parasitaria del donante, el componente sanguíneo transfundido (sangre total presenta mayor riesgo que concentrados de eritrocitos, y estos mayores que plasma), el volumen transfundido, el estado inmunológico del receptor y las condiciones de almacenamiento de la sangre (Cancino, 2016; Carlier y Truyens, 2017). Estudios experimentales han demostrado que el riesgo de transmisión puede alcanzar hasta 25% por unidad transfundida en condiciones óptimas para el parásito, aunque este porcentaje es variable y puede ser menor en sangre almacenada durante períodos prolongados debido a la disminución de la viabilidad parasitaria (Carlier y Truyens, 2017). Es importante resaltar que, a diferencia de la transmisión vectorial donde la fase aguda puede pasar inadvertida, la transmisión transfusional frecuentemente resulta en cuadros agudos sintomáticos, particularmente en receptores inmunocomprometidos, donde la mortalidad puede alcanzar 10-20% sin tratamiento oportuno. Esta realidad subraya la importancia crítica del tamizaje universal en bancos de sangre, especialmente en regiones endémicas donde la prevalencia en donadores puede superar el 1% (Cancino, 2016; Carlier y Truyens, 2017, Dias et. al. 2016).
A nivel mundial, se estima que aproximadamente 6-7 millones de personas están infectadas con T. cruzi, con la mayoría de los casos concentrados en 21 países endémicos de América Latina (OMS, 2020). Gómez-Ochoa et. al. (2022) publicaron un análisis demográfico que evaluó la prevalencia, mortalidad y discapacidad secundaria a la enfermedad de Chagas de 1990 a 2019. Sus resultados revelaron que, aunque la prevalencia global de la enfermedad disminuyó 11.3% durante este período, en México se observó un incremento del 39.58%, ascendiendo del lugar 12 al lugar 5 en el ranking mundial para 2019. Para el caso de la transmisión por vector, la situación epidemiológica de la enfermedad de Chagas en la Huasteca Potosina presenta características particulares que la distinguen de otras regiones endémicas de México. Esta región, caracterizada por su clima cálido-húmedo con temperaturas promedio de 24-26°C y precipitaciones anuales superiores a 1,500 mm, proporciona condiciones óptimas para el desarrollo y proliferación de vectores triatominos. La altitud de la región, que oscila entre 50 y 800 metros sobre el nivel del mar, se encuentra dentro del rango ideal para las especies vectoriales predominantes. Además, factores socioeconómicos como la prevalencia de viviendas rústicas, la presencia de animales domésticos y de corral en el peridomicilio, y las condiciones de marginación social contribuyen a mantener la transmisión activa. Los municipios de San Antonio, Coxcatlán y Tampacán, que han mostrado las mayores prevalencias en estudios previos, comparten características socioeconómicas y ambientales similares: alta proporción de viviendas con piso de tierra (superior al 15%), limitado acceso a servicios básicos, y presencia abundante de reservorios silvestres como zarigüeyas, mapaches y roedores que mantienen el ciclo enzoótico del parásito (Ramsey et. al., 2012; Ballesteros et. al., 2019
Sin embargo, la distribución geográfica de la enfermedad de Chagas en México presenta una marcada heterogeneidad que refleja la compleja interacción entre factores ecológicos, climáticos y socioeconómicos sumados a la historia natural de la enfermedad de por sí compleja. Quijano-Hernández et. al. (2011) establecieron que las zonas rurales ubicadas por debajo de los 2,000 metros sobre el nivel del mar presentan alto riesgo para la enfermedad de Chagas (González-Guzmán et al., 2019). Las regiones Huastecas (hidalguense, potosina, veracruzana y tamaulipeca) se han ratificado consistentemente como zonas de alta endemicidad (Ballesteros et al., 2019; Ramsey et. al., 2012). En 2012, la incidencia fue de 0.70 por cada 100,000 habitantes, y para 2017, las tasas más altas se registraron en Yucatán, Oaxaca e Hidalgo. Para el estado de San Luis Potosí, de acuerdo con datos de la Secretaría de Salud, se han reportado un total de 257 casos infectados en el periodo de 2003 al 2012, siendo las Jurisdicciones Sanitarias V y VI (correspondientes a la región Huasteca) las que registran el mayor número de casos activos de la enfermedad (Medina, H et. al., 2016). Por lo anterior, el Banco de Sangre del Hospital General de Ciudad Valles, el cual recibe población de toda la Huasteca Potosina, representa una oportunidad única para evaluar indirectamente la prevalencia de este protozoario en sujetos asintomáticos durante el proceso de selección de donantes de sangre que acuden a esta Institución.
El diagnóstico serológico de la enfermedad de Chagas en cualquiera de sus fases se basa en la detección de anticuerpos IgG específicos contra antígenos de T. cruzi. Las técnicas disponibles incluyen ensayo inmunoenzimático (ELISA), inmunofluorescencia indirecta (IFI), hemaglutinación indirecta (HAI), quimioluminiscencia y pruebas rápidas inmunocromatográficas. La OMS y el Consenso Brasileño sobre la enfermedad de Chagas recomiendan el uso de al menos dos pruebas serológicas con diferentes principios metodológicos para confirmar el diagnóstico, particularmente en zonas de baja prevalencia donde los valores predictivos positivos pueden ser bajos (Días et. al., 2016). La prueba de quimioluminiscencia Vitros EciQ, utilizada en el Banco de sangre del Hospital General de Ciudad Valles, es un ensayo automatizado de tercera generación que ofrece alta sensibilidad (>99%) y especificidad (>98%), con la ventaja de proporcionar resultados cuantitativos reproducibles y tiempo reducido de procesamiento. Esta tecnología utiliza antígenos recombinantes y/o peptídicos sintéticos que minimizan las reacciones cruzadas con otros parásitos y mejoran la especificidad analítica. Sin embargo, es importante destacar que las pruebas serológicas presentan limitaciones inherentes, especialmente en la fase aguda temprana, cuando los anticuerpos aún no han alcanzado niveles detectables, y en pacientes inmunocomprometidos, donde la respuesta humoral puede estar disminuida (Molina et. al., 2016).
El objetivo de este trabajo fue determinar la seroprevalencia de Trypanosoma cruzi en donadores del Banco de Sangre del Hospital General de Ciudad Valles, San Luis Potosí, durante 2019-2020. Específicamente, se buscó identificar los grupos de edad más afectados, comparar la prevalencia entre sexos, mapear la distribución geográfica de casos positivos por municipio en la Huasteca Potosina, y evaluar la tendencia temporal durante el periodo estudiado.
METODOLOGÍA
Diseño del estudio
La realización de este estudio contó con la aprobación del Comité de Ética e Investigación para la Salud del Hospital General de Ciudad Valles, San Luis Potosí, México (CONBIOÉTICA-24-CEI-002-20190529, protocolo 09/2021). Se realizó un estudio retrospectivo, observacional y descriptivo, en el cual se analizaron los resultados de la prueba serológica anti-T cruzi (reactivo/no reactivo, utilizando el sistema de quimioluminiscencia Vitros EciQ, que considera seropositivos aquellos resultados con valores ≥0.9 unidades de índice) realizada a todos los donadores de sangre que acudieron al Banco de Sangre del Hospital General de Ciudad Valles, San Luis Potosí, durante el periodo comprendido del 1 de enero de 2019 al 31 de diciembre de 2020. De cada registro, se recolectó la edad, el sexo y el lugar de procedencia. Para garantizar la confidencialidad, se trabajó con el número de folio de la unidad obtenida de cada donante, sin incluir nombres u otros datos personales identificables. Análisis estadístico: Se aplicó estadística descriptiva calculando frecuencias absolutas y relativas. La prevalencia se calculó como: (casos positivos / total de muestras) × 100, reportándose con intervalos de confianza del 95% mediante el método de Wilson. La comparación de prevalencias entre años y grupos se realizó mediante prueba de chi-cuadrado (χ²) o prueba exacta de Fisher cuando fue apropiado. Para el análisis por edad, se establecieron 4 grupos etarios con amplitud de 12 años (18-29, 30-41, 42-53, 54-65 años). El nivel de significancia estadística se estableció en p<0.05. El manejo de datos, cálculos y elaboración de tablas se realizaron en el programa Microsoft Excel del paquete Office 365.
RESULTADOS
La prevalencia por año se muestra en la tabla 1. Durante el periodo de estudio se analizaron un total de 7,400 muestras de donadores de sangre, correspondiendo 4,004 (54%) al año 2019 y 3,396 (46%) al año 2020. Se encontró una prevalencia global de 0.70% (IC 95%: 0.44-0.96%) en 2019 y 0.62% (IC 95%: 0.35-0.88%) en 2020, sin diferencia estadísticamente significativa entre ambos años (χ² = 0.18, p = 0.67). Estos valores confirman la circulación activa del parásito en la región, aunque se sitúan por debajo del promedio reportado en otras regiones endémicas de México donde se han documentado prevalencias superiores al 1%.
Tabla 1: prevalencia de T. cruzi por año
|
Año |
Total de muestras |
Positivos T. cruzi |
Prevalencia |
|
2019 |
4004 |
28 |
0.70 (p=ns) |
|
2020 |
3396 |
21 |
0.62 (p=ns) |
Nota. No se encontraron diferencias significativas entre la prevalencia de T. cruzi (prueba chi2, p=ns). Elaboración propia.
El análisis por intervalos de edad (tabla 2 y figura 1) reveló que el grupo de 30 a 41 años presentó la mayor prevalencia en ambos años estudiados. En 2019, este grupo registró una prevalencia de 0.98%, mientras que en 2020 fue de 0.81%. El grupo de 18 a 29 años presentó prevalencias de 0.49% y 0.57% para 2019 y 2020, respectivamente. El grupo de 42 a 53 años mostró prevalencias de 0.66% en 2019 y 0.51% en 2020.Un hallazgo notable fue la ausencia de casos positivos en el grupo de 54 a 65 años durante el año 2020, mientras que en 2019 este grupo presentó una prevalencia de 0.56%. Esta variación podría atribuirse al menor número de donadores en este rango etario o a fluctuaciones estadísticas relacionadas con el tamaño muestral.
Tabla 2: seroprevalencia por intervalo de edad.
|
Intervalo edad |
Prevalencia t. cruzi 2019 |
Prevalencia t. cruzi 2020 |
|
18 a 29 años |
0.49 |
0.57 |
|
30 a 41 años |
0.98 |
0.81 |
|
42 a 53 años |
0.66 |
0.51 |
|
54 a 65 años |
0.56 |
0.00 |
Nota. Los donadores de 30 a 41 años presentaron la mayor prevalencia (2019 y 2020). Interesantemente, no se reportaron casos positivos de T. cruzi en el grupo de 54 a 65 años en el 2020. Elaboración propia.
Figura 1. Seroprevalencia por intervalo de edad.
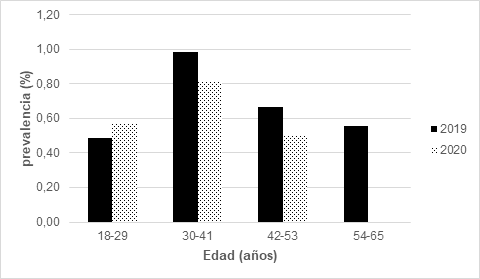
Nota. Los donadores de 30 a 41 años presentaron la mayor prevalencia (2019 y 2020). Interesantemente, no se reportaron casos positivos de T. cruzi en el grupo de 54 a 65 años en el 2020. Elaboración propia.
El análisis por sexo reveló diferencias importantes en la seroprevalencia entre hombres y mujeres durante el año 2019 (ver figura 2). El sexo masculino presentó una prevalencia de 0.75% comparada con 0.35% en el sexo femenino, representando una diferencia de más del doble. Sin embargo, esta diferencia se atenuó en 2020 (mujeres=0.65% y hombres=0.61%), lo que podría reflejar cambios en los patrones de donación o variaciones en la composición demográfica de los donadores.
Figura 2: seroprevalencia por sexo durante 2019 y 2020.
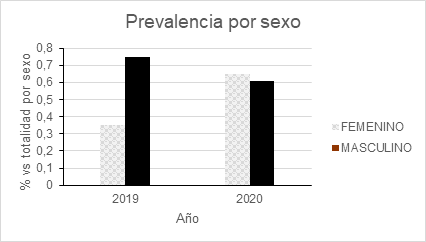
Nota. Durante 2019, se detectó una prevalencia más elevada para el sexo masculino (0.71%) vs el femenino (0.35%). Para 2020, esta diferencia se atenuó (0.65% en mujeres y 0.61% en hombres) Elaboración propia.
La prevalencia obtenida por municipio se muestra en la tabla 3 y figura 3. El análisis por municipio de procedencia reveló una heterogeneidad significativa en la distribución de casos positivos. Los municipios con mayor prevalencia fueron:
San Antonio: Este municipio presentó consistentemente las tasas más altas en ambos años, con 6.38% en 2019 y 5.71% en 2020. Estas cifras son notablemente superiores a la media regional y sugieren condiciones ambientales y socioeconómicas particulares que favorecen la transmisión.
Coxcatlán: Mostró un incremento dramático entre ambos años, pasando de 2.22% en 2019 a 7.41% en 2020, convirtiéndose en el municipio con la prevalencia más alta en el segundo año de estudio.
Tampacán: Registró prevalencias de 2.33% en 2019 y 3.70% en 2020, mostrando un incremento sostenido que requiere atención especial.
Interesantemente, los siguientes municipios registraron seroprevalencia en 2019 únicamente: Tampamolón (4.55%) Tancanhuitz (3.49%) y Axtla de Terrazas (3.39%), San Martín Chalchicuautla: 2.08%. Los que presentaron seroprevalencia solo en el 2020 fueron Ébano (0.93%), Tamasopo (0.67%), Tamuin (0.39%), y Xilitla (0.9%).
Ciudad Valles: a pesar de concentrar el mayor número absoluto de donadores (1,357 en 2019 y 1,252 en 2020), presentó prevalencias relativamente bajas (0.15% en 2019 y 0.32% en 2020). Sin embargo, es preocupante el incremento del doble observado entre ambos años, lo que podría indicar mayor circulación del parásito en zonas periurbanas, migración de población de áreas rurales de alta endemicidad, o mejora en la detección debido a mayor sensibilidad de las técnicas diagnósticas.
Municipios como Matlapa y El Naranjo no registraron casos positivos en ninguno de los dos años estudiados.
Tabla 3. Prevalencia T. Cruzi por municipio de procedencia.
|
Municipio |
Prevalencia T. cruzi 2019 |
Prevalencia T.cruzi 2020 |
|
Aquismón |
0.79 |
0.79 |
|
Axtla de Terrazas |
3.39 |
- |
|
Ciudad Valles |
0.15 |
0.32 |
|
Coxcatlán |
2.22 |
7.41 |
|
Ébano |
- |
0.93 |
|
El Naranjo |
- |
- |
|
Huehuetlán |
2.86 |
2.94 |
|
Matlapa |
- |
- |
|
San Antonio |
6.38 |
5.71 |
|
San Matrín Chalchicuautla |
2.08 |
- |
|
San Vicente Tancuayalab |
1.30 |
1.22 |
|
Tamasopo |
- |
0.67 |
|
Tamazunchale |
0.93 |
0.51 |
|
Tampacan |
2.33 |
3.70 |
|
Tampamolón |
4.55 |
- |
|
Tamuín |
- |
0.39 |
|
Tancanhuitz |
3.49 |
- |
|
Tanlajás |
1.01 |
1.03 |
|
Tanquián de Escobedo |
1.15 |
- |
|
Xilitla |
- |
0.9 |
|
Otros |
0.26 |
- |
Nota. Elaboración propia.
Figura 3: seroprevalencia por municipio de origen durante 2019 y 2020.
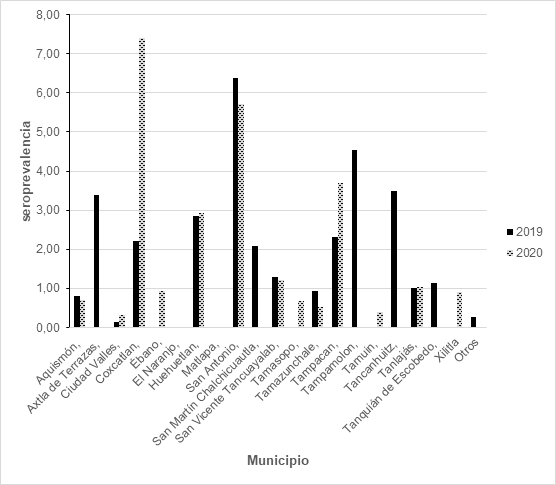
Nota. Ver texto para la descripción. Elaboración propia.
DISCUSIÓN
El presente estudio permitió estimar la seroprevalencia de T. cruzi en donadores del Banco de Sangre del Hospital General de Ciudad Valles durante el periodo 2019-2020, encontrándose valores de 0.69% y 0.61%, respectivamente. Estos resultados se sitúan por debajo del promedio general reportado en la literatura para regiones endémicas de México, donde se han registrado prevalencias superiores al 1%, particularmente en estados como Chiapas, Oaxaca e Hidalgo (Ballesteros et. al., 2019; Rojo-Medina et. al., 2018).
La prevalencia observada en nuestro estudio es comparable con la reportada en otros bancos de sangre de zonas endémicas. Por ejemplo, en Guayaquil, Ecuador, se han reportado prevalencias de 0.038 en 2016, 0.028 en 2017 y 0.051 en 2018 (Velásquez, 2021). Sin embargo, es importante contextualizar que estas cifras pueden variar significativamente según las características socioeconómicas de la población donante y la efectividad de los programas de control vectorial implementados en cada región.
La mayor prevalencia observada en el grupo de 30 a 41 años concuerda con datos publicados por el Sistema Nacional de Vigilancia Epidemiológica (Boletín Epidemiológico, Semana 1, 2021), que señala una mayor incidencia en adultos jóvenes. Este hallazgo resulta particularmente relevante desde la perspectiva de salud pública, ya que este grupo etario representa la población económicamente activa y en edad reproductiva. La mayor prevalencia en este grupo puede explicarse por varios factores interrelacionados. Primero, estos individuos probablemente adquirieron la infección durante su infancia o adolescencia, cuando las condiciones de vivienda y la exposición a vectores eran más frecuentes (Ramsey et. al., 2012). Segundo, este grupo representa la mayor proporción de donadores voluntarios en el banco de sangre, lo que podría influir en la distribución observada. La ausencia de casos positivos en el grupo de 54 a 65 años durante 2020 podría atribuirse a varios factores: mortalidad selectiva, menor participación de este grupo etario en programas de donación de sangre, y posiblemente una menor exposición histórica debido a cambios en las condiciones de vivienda ocurridos en décadas pasadas (Nouvellet et. al., 2015).
La mayor prevalencia observada en donadores masculinos durante 2019 es consistente con estudios previos que han reportado un ligero predominio de infección en hombres (Ballesteros et. al., 2019). Esta diferencia puede explicarse por factores ocupacionales y comportamentales: en contextos rurales, los hombres tienden a desempeñar actividades laborales que implican mayor contacto con ambientes donde los vectores están presentes, tales como trabajo agrícola nocturno, actividades ganaderas y trabajo en áreas forestales (Gürtler et. al., 2014). Sin embargo, es importante señalar que algunos estudios han reportado prevalencias similares entre ambos sexos, particularmente en estudios de base poblacional que no están sesgados por patrones de participación en donación de sangre (Manne-Goehler et. al., 2016). La atenuación de la diferencia observada en 2020 podría reflejar esta variabilidad inherente.
Los municipios de San Antonio, Coxcatlán y Tampacán presentaron las mayores tasas de seroprevalencia, con valores que en algunos casos superaron el 5%. Estas cifras, significativamente superiores a la media regional, sugieren la presencia de condiciones particulares que favorecen la transmisión del parásito. Entre los factores que podrían explicar esta alta endemicidad se encuentran: características de las viviendas que facilitan el establecimiento de colonias intradomiciliarias de triatominos (construcciones con grietas, techos de palma, paredes de adobe sin recubrimiento), condiciones socioeconómicas desfavorables que limitan el acceso a mejoras habitacionales, presencia abundante de vectores y reservorios animales, y posiblemente una menor cobertura de las campañas de control vectorial (Martínez-Ibarra et. al., 2015). El incremento de casos en Ciudad Valles entre ambos años, aunque partiendo de prevalencias bajas, merece atención especial. Este fenómeno podría estar vinculado a la migración de población de áreas rurales de alta endemicidad hacia la cabecera municipal, la expansión de asentamientos urbanos hacia zonas periurbanas donde persisten condiciones favorables para los vectores, o simplemente una mejor detección debido a mejoras en las técnicas diagnósticas.
Los resultados obtenidos respaldan firmemente la eficacia del tamizaje serológico obligatorio en bancos de sangre establecido por la NOM-253-SSA1-2012. Durante el periodo de estudio se identificaron 49 donadores seropositivos que, de no haberse detectado, habrían representado un riesgo potencial de transmisión transfusional. Considerando que el riesgo de transmisión por transfusión de sangre infectada oscila entre 10-25%, la detección y exclusión de estas unidades evitó potencialmente entre 5 y 12 casos de infección transfusional durante el periodo estudiado. Este hallazgo cobra especial relevancia al considerar que los receptores de transfusiones frecuentemente son pacientes inmunocomprometidos o con condiciones médicas graves, en quienes una infección aguda por T. cruzi podría tener consecuencias fatales. Por lo tanto, el mantenimiento riguroso de los protocolos de tamizaje constituye una herramienta fundamental de salud pública que debe preservarse y fortalecerse.
Limitaciones del estudio
La principal limitación radica en la naturaleza retrospectiva del estudio y la ausencia de seguimiento clínico de los casos detectados, lo que impide conocer el estadio de la enfermedad, la presencia de manifestaciones clínicas y la respuesta al tratamiento. Adicionalmente, no se realizó tipificación molecular de las cepas circulantes, lo que habría permitido comprender mejor la diversidad genética del parásito en la región. Otra limitación importante es el sesgo de selección inherente a los estudios basados en donadores de sangre, quienes representan un segmento relativamente saludable de la población. Por lo tanto, la prevalencia observada podría subestimar la verdadera carga de enfermedad en la población general de la región.
CONCLUSIONES
Este estudio documenta la persistencia de la infección por T. cruzi como un problema de salud pública en la región huasteca potosina de naturaleza subclínica. La seroprevalencia observada en donadores de sangre (0.70% en 2019 y 0.62% en 2020) probablemente subestima la prevalencia real en la población general de la Huasteca Potosina, dado que los donadores constituyen un grupo con sesgo de selección hacia individuos aparentemente sanos. Los resultados obtenidos respaldan la eficacia del tamizaje serológico obligatorio en bancos de sangre como medida de prevención de la transmisión transfusional. Durante el periodo de estudio, la detección de 49 donadores seropositivos evitó potencialmente entre 5 y 12 casos de infección transfusional, lo que subraya la importancia crítica de mantener y fortalecer estos protocolos de seguridad transfusional
Aunque estas cifras son menores a las reportadas en otros estudios nacionales, confirman la circulación activa del parásito en la región. El grupo de edad de 30 a 41 años presentó la mayor prevalencia en ambos años estudiados, coincidiendo con la población económicamente activa y en edad reproductiva. Durante 2019 se observó una mayor prevalencia en donadores masculinos comparada con el sexo femenino, diferencia que se atenuó en 2020. Los municipios de San Antonio, Coxcatlán y Tampacán presentaron las tasas más altas de seroprevalencia, con valores que superaron el 5% en algunos casos. Estas áreas requieren intervenciones focalizadas que incluyan intensificación del control vectorial, mejoramiento de las condiciones habitacionales y fortalecimiento de la vigilancia epidemiológica.
Este trabajo representa una contribución al conocimiento epidemiológico de la enfermedad de Chagas en San Luis Potosí en poblaciones aparentemente sanas y proporciona una línea base para evaluar el impacto de futuras intervenciones de control. Se requieren estudios adicionales que incluyan seguimiento clínico de los casos detectados, caracterización molecular de las cepas circulantes y evaluación de la transmisión congénita para complementar el panorama epidemiológico de la región.
Las perspectivas de investigación futura derivadas de este trabajo son amplias y requieren aproximaciones multidisciplinarias. En primer lugar, resulta fundamental establecer un sistema de seguimiento clínico de los donadores seropositivos identificados durante este estudio. Este seguimiento debería incluir la caracterización molecular de las cepas de T. cruzi circulantes en la región mediante técnicas moleculares como PCR y secuenciación genética permitiría identificar las unidades discretas de tipificación (DTUs) predominantes. Estudios previos han demostrado que diferentes DTUs (TcI, TcII, TcIII, TcIV, TcV, TcVI) presentan distinto tropismo tisular y se asocian con diferentes patrones clínicos, lo que podría explicar las variaciones en manifestaciones clínicas observadas en diferentes regiones geográficas. Esta información también sería valiosa para estudios filogenéticos que ayuden a comprender las rutas de dispersión del parásito y su evolución en diferentes nichos ecológicos.
Desde el punto de vista de políticas públicas, los resultados de este estudio refuerzan la necesidad de mantener y fortalecer el marco normativo existente. La NOM-253-SSA1-2012 ha demostrado ser efectiva en prevenir la transmisión transfusional, pero requiere fortalecimiento en varios aspectos. Primero, es necesario asegurar el abastecimiento continuo de reactivos de alta calidad y la calibración regular de equipos en todos los bancos de sangre del país, particularmente en instituciones públicas de zonas rurales donde los recursos pueden ser limitados. Segundo, se sugiere establecer un sistema nacional de registro y seguimiento de donadores seropositivos que permita su notificación, orientación y referencia a servicios especializados para evaluación clínica y, cuando está indicado, tratamiento antiparasitario. Actualmente, en muchas instituciones, los donadores rechazados por serología positiva no reciben seguimiento adecuado, perdiéndose la oportunidad de brindar atención médica y prevenir transmisión secundaria. Tercero, se sugiere fortalecer la capacidad diagnóstica y terapéutica en el primer nivel de atención mediante capacitación continua del personal médico y de enfermería, disponibilidad de pruebas rápidas para tamizaje en zonas remotas, y acceso garantizado a medicamentos antiparasitarios indicados. La descentralización del tratamiento de casos no complicados desde hospitales especializados hacia centros de salud rurales permitiría aumentar la cobertura y mejorar la adherencia terapéutica al reducir barreras geográficas y económicas para los pacientes.
BIBLIOGRAFÍA
Ballesteros, G., Ruiz-Matus, C., Jiménez-Corona, M. E., Martínez, I., Martínez-Ibarra, J. A., Valdez-Tah, A., & Molina-Garza, Z. J. (2019). Enfermedad de Chagas en México: una revisión de la situación epidemiológica y de las prioridades de investigación. Revista Biomédica, 30(2), 83-94.
Bayer, A. M., Hunter, G. C., Gilman, R. H., Cornejo del Carpio, J. G., Naquira, C., Bern, C., & Levy, M. Z. (2009). Chagas disease, migration and community settlement patterns in Arequipa, Peru. PLoS Neglected Tropical Diseases, 3(12), e567. https://doi.org/10.1371/journal.pntd.0000567
Berrizbeitia, M., González, F., Ndao, M., Ward, B., Rodríguez, J., & Cortéz, Y. (2014). Seroprevalencia de infección por Trypanosoma cruzi en bancos de sangre públicos del oriente de Venezuela. Kasmera, 42(1), 83-95.
Cancino, M. B. (2016). Enfermedad de Chagas: aspectos clínicos, epidemiológicos y diagnósticos. Revista Médica de Chile, 144(2), 247-255.
Carlier, Y., & Truyens, C. (2017). Maternal-fetal transmission of Trypanosoma cruzi. En J. Telleria & M. Tibayrenc (Eds.), American Trypanosomiasis Chagas Disease: One Hundred Years of Research (2ª ed., pp. 517-550). Elsevier.
Carrada-Bravo, T. (2004). Trypanosoma cruzi: Historia natural y diagnóstico de la enfermedad de Chagas. Revista Mexicana de Patología Clínica, 51(4), 205-219.
Castañeda-Porras, O., Cárdenas-Bernal, Á. M., Santamaría-Escobar, B., & Gómez-Camargo, D. E. (2021). Prevalencia de Infección por Trypanosoma cruzi en donantes de un banco de sangre de Boyacá, Colombia. Revista de la Asociación Colombiana de Ciencias Biológicas, 33(1), 28-37. http://dx.doi.org/10.47499/reviaccbiol.v33i1.99
Centers for Disease Control and Prevention. (2019). Chagas disease. https://www.cdc.gov/parasites/chagas/
Chagas, C. (1910). Nova entidade morbida do homem. Brazil-Medico, 24(43-45), 423-428, 433-437, 443-447.
Coura, J. R., & Viñas, P. A. (2010). Chagas disease: a new worldwide challenge. Nature, 465(7301), S6-S7. https://doi.org/10.1038/nature09221
Cruz-Reyes, A., & Pickering-López, J. M. (2006). Chagas disease in Mexico: an analysis of geographical distribution during the past 76 years. Memórias do Instituto Oswaldo Cruz, 101(4), 345-354.
Cucunubá, Z. M., Nouvellet, P., Peterson, J. K., Bartsch, S. M., Lee, B. Y., Dobson, A. P., & Basáñez, M. G. (2017). Complementary paths to chronic Chagas disease: Combination of genetic and environmental factors. PLoS Neglected Tropical Diseases, 11(9), e0005858. https://doi.org/10.1371/journal.pntd.0005858
Días, J. C. P., Ramos, A. N., Gontijo, E. D., Luquetti, A., Shikanai-Yasuda, M. A., Coura, J. R., Torres, R. M., Melo, J. R. C., Almeida, E. A., Oliveira, W., Silveira, A. C., Rezende, J. M., Pinto, F. S., Ferreira, A. W., Rassi, A., Fragata Filho, A. A., Sousa, A. S., Correia, D., Jannuzzi, A. C. V., ... Alves, R. V. (2016). 2nd Brazilian Consensus on Chagas Disease, 2015. Revista da Sociedade Brasileira de Medicina Tropical, 49(Suppl 1), 3-60. https://doi.org/10.1590/0037-8682-0505-2016
Field-Cortázares, J., & Escobedo-Ortegón, J. (2019). Trypanosoma cruzi: mecanismos de evasión de la respuesta inmune. Revista Biomédica, 30(1), 36-50.
Freilij, H., & Altcheh, J. (1995). Congenital Chagas' disease: diagnostic and clinical aspects. Clinical Infectious Diseases, 21(3), 551-555.
Gascon, J., Bern, C., & Pinazo, M. J. (2010). Chagas disease in Spain, the United States and other non-endemic countries. Acta Tropica, 115(1-2), 22-27. https://doi.org/10.1016/j.actatropica.2009.07.019
Gómez-Ochoa, S. A., Rojas, L. Z., Echeverría, L. E., Muka, T., & Franco, O. H. (2022). Global, regional, and national trends of Chagas disease from 1990 to 2019: Comprehensive analysis of the Global Burden of Disease Study. Global Heart, 17(1), 1-11. https://doi.org/10.5334/GH.1150
González-Guzmán, R., Ibarra-Cerdeña, C. N., Trujillo-Contreras, F., Sánchez-Cordero, V., & Ramsey, J. M. (2019). Enfermedad de Chagas en el Estado de México y áreas contiguas: análisis retrospectivo de seroprevalencia en bancos de sangre, 2008-2015. Salud Pública de México, 61(5), 642-649.
Gürtler, R. E., Cecere, M. C., Vazquez-Prokopec, G. M., Ceballos, L. A., Gurevitz, J. M., Fernández, M. P., Kitron, U., & Cohen, J. E. (2014). Domestic animal hosts strongly influence human-feeding rates of the Chagas disease vector Triatoma infestans in Argentina. PLoS Neglected Tropical Diseases, 8(5), e2894. https://doi.org/10.1371/journal.pntd.0002894
Manne-Goehler, J., Umeh, C. A., Montgomery, S. P., & Wirtz, V. J. (2016). Estimating the burden of Chagas disease in the United States. PLoS Neglected Tropical Diseases, 10(11), e0005033. https://doi.org/10.1371/journal.pntd.0005033
Manual de Procedimientos para la Enfermedad de Chagas. (2019). Secretaría de Salud, Dirección General de Epidemiología. Ciudad de México, México.
Martínez-Ibarra, J. A., Alejandre-Aguilar, R., Paredes-González, E., Martínez-Silva, M. A., Solorio-Cibrián, M., Nogueda-Torres, B., Trujillo-Contreras, F., Novelo-López, M., & Bárcenas-Contreras, N. M. (2015). Biology of three species of North American triatomines (Hemiptera: Reduviidae: Triatominae): Triatoma recurva, Triatoma protracta and Triatoma lecticularia. Memórias do Instituto Oswaldo Cruz, 110(5), 659-663. https://doi.org/10.1590/0074-02760150111
Medina, H., Contreras-Servin, C., Galindo-Mendoza, M. G., & Arreola-Martínez, B. E. (2016). Modelado espacial bayesiano de la enfermedad de Chagas en la Huasteca Potosina. Revista Biomédica, 27(3), 97-114. https://doi.org/10.32776/revbiomed.v27i3.381
Molina, I., Salvador, F., & Sánchez-Montalvá, A. (2016). Actualización en enfermedad de Chagas. Enfermedades Infecciosas y Microbiología Clínica, 34(2), 132-138. https://doi.org/10.1016/j.eimc.2015.12.008
Monteón, V. M., Reyes-López, P. A., Sosa-Palacio, A., León-Tello, G., Martínez-Murguía, J., & Sosa-Jurado, F. (2005). Distribución heterogénea de la prevalencia de anticuerpos contra Trypanosoma cruzi en donadores de sangre en Puebla, México. Salud Pública de México, 47(2), 116-125.
NOM-253-SSA1-2012. (2012). Para la disposición de sangre humana y sus componentes con fines terapéuticos. Diario Oficial de la Federación, Estados Unidos Mexicanos.
Nouvellet, P., Dumonteil, E., & Gourbière, S. (2015). The improbable transmission of Trypanosoma cruzi to human: the missing link in the dynamics and control of Chagas disease. PLoS Neglected Tropical Diseases, 9(11), e0004296. https://doi.org/10.1371/journal.pntd.0004296
Organización Mundial de la Salud. (2010). Primer informe de la OMS sobre enfermedades tropicales desatendidas: Trabajar para superar el impacto mundial de las enfermedades tropicales desatendidas. Ginebra: OMS. https://www.who.int/publications/i/item/9789241564090
Organización Mundial de la Salud. (2020). Enfermedad de Chagas (tripanosomiasis americana). https://www.who.int/es/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis)
Quijano-Hernández, I., Dumonteil, E., & Espinoza, B. (2011). Identification of triatomine vectors associated with Chagas disease transmission in the State of Hidalgo, Mexico. Revista do Instituto de Medicina Tropical de São Paulo, 53(6), 307-312. https://doi.org/10.1590/S0036-46652011000600003
Ramsey, J. M., Gutiérrez-Cabrera, A. E., Salgado-Ramírez, L., Peterson, A. T., Sánchez-Cordero, V., & Ibarra-Cerdeña, C. N. (2012). Ecological connectivity of Trypanosoma cruzi reservoirs and Triatoma pallidipennis hosts in an anthropogenic landscape with endemic Chagas disease. PLoS ONE, 7(9), e46013. https://doi.org/10.1371/journal.pone.0046013
Ramsey, J. M., Ordóñez, R., Cruz-Celis, A., Álvear, A. L., Chávez, V., López, R., Pintor, J. R., Gama, F., & Carrillo, S. (2015). Distribution of domestic Triatominae and stratification of Chagas Disease transmission in Oaxaca, Mexico. Medical and Veterinary Entomology, 14(1), 19-30.
Ramos-Ligonio, A., López-Monteon, A., Guzmán-Gómez, D., Rosales-Encina, J. L., Limón-Flores, A. Y., & Dumonteil, E. (2022). Seroprevalence of Trypanosoma cruzi in Eight Blood Banks in Mexico. Archives of Medical Research, 53(6), 595-601. https://doi.org/10.1016/j.arcmed.2022.07.004
Requena-Méndez, A., Aldasoro, E., de Lazzari, E., Sicuri, E., Brown, M., Moore, D. A., Gascon, J., & Muñoz, J. (2015). Prevalence of Chagas disease in Latin-American migrants living in Europe: A systematic review and meta-analysis. PLoS Neglected Tropical Diseases, 9(2), e0003540. https://doi.org/10.1371/journal.pntd.0003540
Rocha-Muñoz, L. P., Hernández-Peñaranda, I. P., Martínez-Pedroza, D. M., & Castellanos-Domínguez, Y. Z. (2014). Trypanosoma cruzi: prevalencia y factores de riesgo de seropositividad en donantes de sangre del Hemocentro y Unidad de Aféresis, Valledupar, Colombia, 2013-2014. Medicina & Laboratorio, 20(11-12), 529-542.
Rojo-Medina, J., Ruiz-Matus, C., Salazar-Schettino, P. M., & González-Roldán, J. F. (2018). Enfermedad de Chagas en México. Gaceta Médica de México, 154(5), 605-612. https://doi.org/10.24875/GMM.18004515
Romaña, C. (1935). Acerca de un síntoma inicial de valor para el diagnóstico de forma aguda de la enfermedad de Chagas. La conjuntivitis esquizotripanósica unilateral (hipótesis sobre puerta de entrada conjuntival de la enfermedad). Publicación MEPRA, 22, 16-28.
Salazar Schettino, P. M., de Haro Arteaga, I., & Cabrera Bravo, M. (2005). Tres especies de triatominos y su importancia como vectores de Trypanosoma cruzi en México. Medicina, 65(1), 63-69.
Salazar-Schettino, P. M., Rojas-Wastavino, G. E., Cabrera-Bravo, M., Bucio-Torres, M. I., Martínez-Ibarra, J. A., Monroy-Escobar, M. C., Rodas-Retana, A., Guevara-Gómez, Y., Vences-Blanco, M. O., Torrico, F., Altcheh, J., & Pérez-Molina, J. A. (2016). Revisión de 13 especies de la familia Triatominae (Hemiptera: Reduviidae) vectores de la enfermedad de Chagas, en México. Journal of the Selva Andina Research Society, 7(2), 57-80.
Sistema Nacional de Vigilancia Epidemiológica. (2021). Boletín Epidemiológico, Semana 1. Secretaría de Salud, México.
Velásquez, G. (2021). Prevalencia de infección por Trypanosoma cruzi en donantes de sangre en Guayaquil, Ecuador, 2016-2018. Revista Ecuatoriana de Medicina y Ciencias Biológicas, 42(1), 23-29.